Di tahun 1884, the Swedish chemist Svante Arrhenius mengajukan dua spesifikasi senyawa, yaitu asam dan basa. Apa sebenarnya dua senyawa ini? Kamu pasti sering mendengarnya di kelas sains, bukan?
Asam dan basa merupakan senyawa yang dapat berinteraksi satu sama lain dan menghasilkan formasi garam dan air.
Istilah asam dan basa memiliki banyak definisi, tergantung dari cara melihat kandungan senyawa tersebut. Arrhenius pertama kali mendefinisikan asam sebagai senyawa yang diionisasi untuk memproduksi ion hidrogen, dan basa merupakan senyawa yang diionisasi untuk memproduksi ion hidroksida. Namun menurut definisi Lowry-Bronsted, asam adalah donor proton dan basa adalah penerima proton.
Lalu Lewis mendefinisikan asam sebagai molekul atau ion yang mampu berkoordinasi dengan pasangan elektron, dan basa merupakan molekul atau ion yang memiliki pasangan elektron yang dapat dibagi dengan asam. Dalam definisi Lewis, agar sesuatu dapat disebut asam, maka ia harus memiliki sedikit elektron.
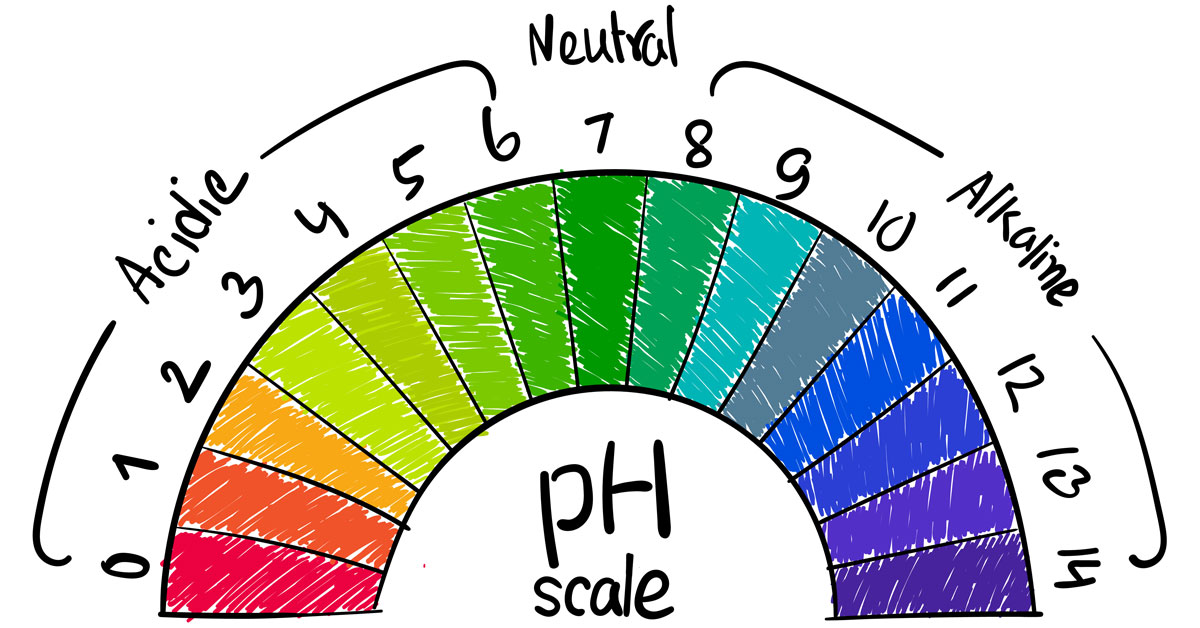
Dalam rangka mengetahui tingkat keasaman atau kebasaan suatu zat, maka digunakanlah skala pH (potential Hydrogen). Skala ini memiliki nilai dari 0 hingga 14.
Berikut merupakan cara mengukurnya:
Cara lain mengetahui tingkat keasaman dan kebasaan adalah dengan menggunakan litmus paper. Ada 2 jenis kertas litmus yang dapat digunakan, yaitu kertas litmus merah dan kertas litmus biru.
Senyawa Asam
Asam adalah senyawa yang sering terkandung pada buah-buahan yang terasa asam seperti jeruk dan anggur. Rasa asam sebenarnya adalah senyawa kimia yang dapat larut di dalam air. Senyawa asam membuat pH air menjadi lebih kecil dari 7. Dalam bahasa yang lebih ilmiah, asam adalah zat yang memberikan proton atau ion H+ kepada zat lain.
Kata acid itu sendiri berasal dari bahasa Latin ‘acere’ yang artinya asam. Dalam kehidupan sehari-hari, kita sering menggunakan senyawa ini. Misalnya pada saat susu berubah menjadi asam, itu karena ia mengandung lactic acid.
Semua hal yang terasa asam dapat dipastikan memiliki kandungan asam di dalamnya.
Asam memiliki sifat antara lain:
- Rasa: Masam atau kecut dalam Bahasa Jawa jika dilarutkan dalam air.
- Sentuhan: Asam yang sangat pekat akan terasa menyengat jika terkena kulit, bahkan dapat merusak sel kulit.
- Kereaktifan: Asam dapat bereaksi dengan baik jika bertemu dengan logam. Bahkan dapat membuat logam lama-lama mengalami korosi.
- Hantaran listrik: Larutan asam adalah larutan elektrolit yang sangat baik dalam fungsinya sebagai konduktor elektrik.
- Kandungan pH selalu kurang dari 7
Apa Saja Senyawa Yang Termasuk Asam Kuat?
- Aqua Regina (campuran antara H2SO4 dengan HNO3)
- HNO3
- Asam halida
- Asam oksi halogen
- Asam sulfur H2SO4
- Acetic acid CH3COOH
Penggunaan Asam
- Menghilangkan karat dari logam pada proses pickling
- Sebagai elektrolit di dalam baterai sel basah
- Asam klorida merupakan asam lambung yang dapat berguna bagi pencernaan
- Sebagai katalis dalam atau zat yang mempercepat reaksi
Senyawa Basa
Basa adalah senyawa yang banyak digunakan dalam campuran sabun mandi atau sabun cuci. Secara kimia, basa adalah senyawa yang menyerap ion hydronium ketika dilarutkan ke dalam air. Basa adalah lawan dari asam. Jika kedua larutan asam dan basa disatukan akan saling menetralkan. Jika larut dalam air maka pH larutan akan menjadi lebih dari 7.
Dari kuat atau tidaknya, maka basa dibagi menjadi dua jenis, yaitu basa kuat yang sering disebut kostik dan basa lemah. Kemampuan ini didasarkan pada kemampuan melepaskan ion OH– dalam larutan dan juga konsentrasi larutan yang dihasilkan.
Basa dikarakteristikan memiliki rasa yang pahit dan tekstur licin. Basa yang dapat larut dalam air lebih dikenal dengan sebutan alkali.
Basa memiliki sifat antara lain:
- Rasa: Cenderung pahit jika dirasakan dengan lidah.
- Sentuhan: Basa akan terasa licin jika disentuh dan bercampur dengan air. Seperti sabun yang sering kita gunakan.
- Kereaktifan: Basa juga dapat menyebabkan pelapukan pada logam seperti layaknya asam.
- Hantaran listrik: Larutan basa adalah larutan elektrolit yang berfungsi sebagai konduktor elektrik.
- Kandungan pH selalu di atas 7
Contoh Larutan Dengan Basa kuat:
- Kalium hidroksida (KOH)
- Barium hidroksida (Ba(OH)2)
- Caesium hidroksida (CsOH)
- Natrium hidroksida (NaOH)
- Stronsium hidroksida (Sr(OH)2)
- Kalsium hidroksida (Ca(OH)2)
- Magnesium hidroksida (Mg(OH)2)
- Litium hidroksida (LiOH)
- Rubidium hidroksida (RbOH)
Contoh Larutan Dengan Basa Lemah:
- Gas amoniak (NH3)
- Besi hidroksida (Fe(OH)2)
- Hydroxylamine (NH2OH)
- Aluminium hidroksida (Al(OH)3)
- Ammonia hydroxide (NH4OH)
- Metilamin hydroxide (CH3NH3OH
- Metilamin hydroxide (C2H5NH3OH)
Penggunaan Basa
- Alumunium hidroksida (AI[OH]3) digunakan dalam pembuatan deodoran.
- Kalsium hidroksida (Ca(OH)2) digunakan dalam pembuatan plester.
- Magnesium hidroksida (Mg(OH)2) digunakan dalam pembuatan Antasida (obat lambung)
- Natrium hidroksida (NaOH) digunakan dalam pembersihan saluran pipa.
- Kalium hidroksida (KOH) digunakan dalam pembuatan sabun.
- Amonium hidroksida (NH4OH) digunakan dalam pembuatan desinfektan.
Apakah informasi di atas memberikan pengetahuan yang berguna untuk kamu? Tinggalkan pertanyaan dan pesanmu di kolom komentar, serta jangan lupa untuk membagikan tulisan ini kepada teman-temanmu, ya!